Utilidad de los Marcadores Bioquímicos de Recambio Óseo

Pruebas rápidas para detección de Carbapenamasas
septiembre 20, 2022
Interferencias en las Pruebas de Inmunoensayo
noviembre 28, 2022Los marcadores bioquímicos de recambio o también conocidos como de remodelación ósea, han sido de gran interés para evaluar el metabolismo de los huesos y enfermedades que los afectan, en especial la osteoporosis. En los adultos el tejido óseo está en permanente proceso de recambio.
El balance entre los procesos de formación y remodelación a través de la disponibilidad de una serie de sustancias que evidencian estas actividades ha permitido el estudio y análisis de su disponibilidad, lo cual ha permitido una mejor comprensión de la fisiología, aplicaciones clínicas y posibles formas de optimizar las técnicas analíticas para diagnóstico y seguimiento de las enfermedades que afectan la calidad del hueso principalmente.
El hueso es un tejido dinámico formado por células y una matriz extracelular que contiene moléculas orgánicas (35%) e inorgánicas (65%). La matriz orgánica está compuesta predominantemente por colágeno tipo I (90%) con pequeñas cantidades de proteínas no colágenas como la osteocalcina (OC), glicoproteínas y proteoglicanos. El calcio y el fosfato inorgánicos forman cristales de hidroxiapatita que mineralizan la matriz orgánica.
Tres tipos principales de células óseas participan en el proceso de remodelación ósea, que son los osteoclastos, los osteoblastos y los osteocitos. Los osteoblastos se encargan del depósito y la mineralización de la nueva matriz ósea, mientras que los osteoclastos son responsables de la reabsorción ósea. Los osteocitos que componen más del 95% del tejido óseo actúan principalmente para sintetizar y reabsorber la matriz ósea, así como de actividades para estimular el movimiento óseo y atender las necesidades del cuerpo a través de señales bioquímicas.
La remodelación ósea ocurre en focos discretos de células llamadas unidades multicelulares básicas. Es un proceso cíclico esencial para el crecimiento del esqueleto y el proceso consta de cuatro fases: reabsorción, inversión, formación y una fase de reposo.
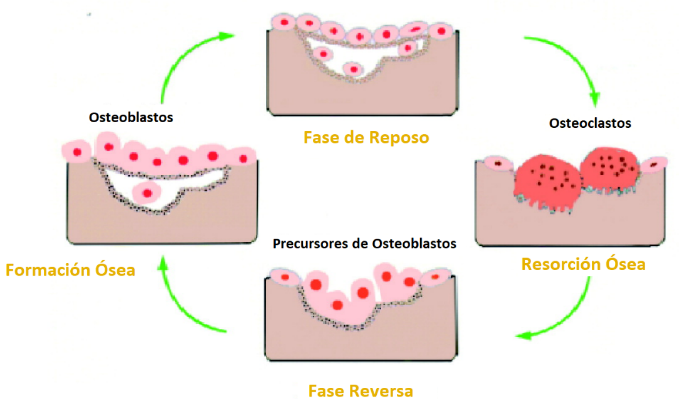
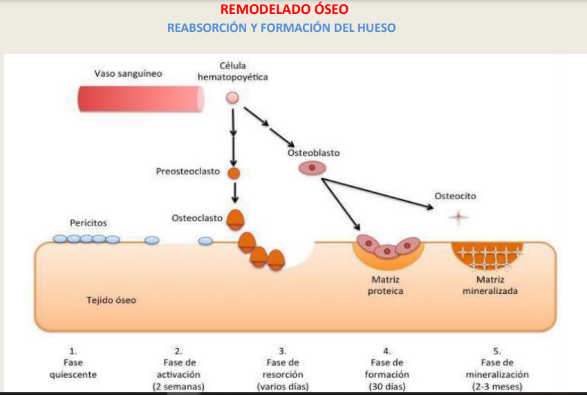
Un ciclo típico, la fase de reabsorción dura entre 7 y 10 días, mientras que la formación dura hasta 2– 3 meses. En el esqueleto de un adulto joven sano, el recambio óseo está en equilibrio y no se produce una pérdida neta de hueso.
La tasa de remodelación ósea se ve influida por el estrés mecánico, las hormonas sistémicas como la hormona de crecimiento, vitamina D o la Parathormona entre otras y factores intrínsecos (como las citocinas y los factores de crecimiento). Los cambios en el remodelado óseo se reflejan en los marcadores óseos, los cuales son producidos durante las diferentes fases del proceso.
Marcadores de Recambio Óseo
Los marcadores bioquímicos de recambio óseo se pueden dividir en marcadores de formación y resorción, aunque algunos pueden reflejar ambas actividades. Los marcadores de formación ósea son producidos por células osteoblásticas o derivados del metabolismo del procolágeno, mientras que los marcadores de resorción son los productos de degradación de los osteoclastos o la degradación del colágeno.
- Marcadores de formación ósea
Fosfatasa Alcalina Ósea. La fosfatasa alcalina (FAL) es una enzima presente en casi todos los tejidos del cuerpo. Hay cuatro isoenzimas de ALP en la circulación: intestinal, placentaria, células germinales y una forma no específica. La fosfatasa alcalina específica del hueso es producida por los osteoblastos y su producción está correlacionada positivamente con la tasa de formación de hueso medida por histomorfometría. La Fosfatasa alcalina ósea puede medirse en suero por electroforesis, inmunorradiometría, inmunoensayos enzimáticos y cromatografía líquida de alta resolución (HPLC).
Osteocalcina (OC). Es una pequeña proteína no colágena que comprende aproximadamente el 2% de la proteína total en el cuerpo humano. Contiene ácido gamma-carboxiglutámico óseo, está compuesta por 49 aminoácidos es sintetizada por osteoblastos maduros, odontoblastos y condrocitos hipertróficos.
La OC producida por los osteoblastos juega un papel importante en la regulación metabólica, la mineralización ósea y la homeostasis de iones de calcio. Está demostrado que el nivel de OC en suero está altamente correlacionado con el aumento de la Densidad Mineral Ósea durante el tratamiento con fármacos formadores de hueso para la osteoporosis, por lo que se ha considerado como un biomarcador específico para la tasa de formación ósea en esta patología. El uso de la OC como biomarcador de formación ósea proporciona ventajas tales como especificidad tisular, amplia disponibilidad y baja variación. Además de la evaluación de la osteoporosis, también se ha estudiado su utilidad en la predicción del riesgo de fractura en personas mayores, especialmente en mujeres. Su medición sérica está disponible principalmente por inmunoensayos tipo ELISA o por quimioluminiscencia, estos últimos permiten tener disponibilidad en plataformas de uso rutinario con excelentes características de desempeño analítico.
Propéptido N-terminal de procolágeno tipo 1 (P1NP). Este producto es formado principalmente por osteoblastos y fibroblastos a partir del proceso de formación del Colágeno 1. El P1NP es estable durante cinco días tanto a temperatura ambiente como a 4 ℃. También ha mostrado excelente correlación con la densidad mineral ósea, y actualmente su medición sérica puede hacerse a través de ensayos radiométricos o por quimioluminiscencia y los recientes estudios clínicos con este marcador lo han posicionado como una excelente herramienta diagnóstica para evaluación del paciente osteoporótico principalmente y de riesgo de fracturas. El seguimiento de las concentraciones de los péptidos de procolágeno como P1NP es muy útil para estudiar la efectividad de tratamientos antirresortivos (como los estrógenos y los bisfosfonatos) de los agentes anabólicos como la hormona paratiroidea recombinante humana.
- Marcadores de resorción ósea
Moléculas de enlace cruzado de colágeno (CrossLaps). La piridinolina (PYD) y la desoxipiridinolina (DPD) son moléculas que estabilizan mecánicamente la molécula de colágeno mediante la reticulación entre péptidos de colágeno individuales. El PYD se encuentra en el cartílago, el hueso, los ligamentos y los vasos sanguíneos, mientras que el DPD se encuentra casi exclusivamente en el hueso y la dentina. Por lo tanto, DPD es un marcador más específico y sensible que PYD.
Los enlaces cruzados de colágeno se forman durante la maduración extracelular del colágeno y se liberan a la circulación a partir de la degradación de los colágenos maduros. PYD y DPD se excretan en la orina en forma libre (40%) y unida a péptido (60%). Los enlaces cruzados se pueden medir tanto en muestras de orina cronometradas como aleatorias, pero la orina puntual de la mañana es una muestra preferida debido a la variación diurna de los enlaces cruzados. Aunque los enlaces cruzados no se ven afectados por la ingesta dietética, la exposición de las muestras de orina a la luz ultravioleta reduce las concentraciones de DPD y PYD. Las metodologías disponibles para el análisis de estos biomarcadores son la cromatagrafía líquida de alta resolución (HPLC) o inmunoensayos automatizados que detectan las fracciones libres ligadas a proteínas o las formas libres.
Telopéptidos reticulados de colágeno I. Los telopéptidos de colágeno tipo 1 son los marcadores de resorción ósea más ampliamente estudiados y utilizados. Existen dos formas según el sitio de formación de enlaces cruzados con el colágeno: el telopéptido N-terminal (NTX) y el telopéptido C-terminal (CTX), que se liberan durante la degradación del colágeno. Los métodos analíticos disponibles para los dos tipos de telopéptido incluyen ELISA, RIA y los más sensibles por Quimioluminiscencia. y de alto rendimiento después de medir CTX Aunque pueden medirse en orina estos biomarcadores se miden preferiblemente en suero o plasma en ayunas, lo cual es más ventajoso porque los ensayos muestran una mejor reproducibilidad y porque se evita la necesidad de corregir la excreción de creatinina lo cual agrega variabilidad al resultado. Hay otros biomarcadores de resorción como la Hidroxiprolina que se liberan también a partir de la degradación del colágeno, pero su medición por los métodos existentes como HPLC o ELISA, puede verse afectada por la dieta principalmente lo cual afecta la sensibilidad clínica del biomarcador se mide en la orina por métodos colorimétricos o HPLC. Su uso ha sido superado por marcadores más sensibles y específicos. También está la Hidroxilisina-glucósida que a diferencia de Hidroxiprolina no se ve afectada por la ingesta dietética y sus glucósidos sólo se derivan de la resorción ósea, sin embargo la disponibilidad de ensayos es limitada para el uso rutinario en el laboratorio así mismo es el caso de la Fosfatasa ácida tartrato resistente (TRACP), sustancia formada a partir de la actividad de los osteoclastos es otro marcador prometedor así como la Sialoproteína ósea (BSP), glicoproteína no colágena fosforilada de la matriz ósea que está exclusivamente en tejidos mineralizados como hueso, dentina y cartílago hipertrófico.
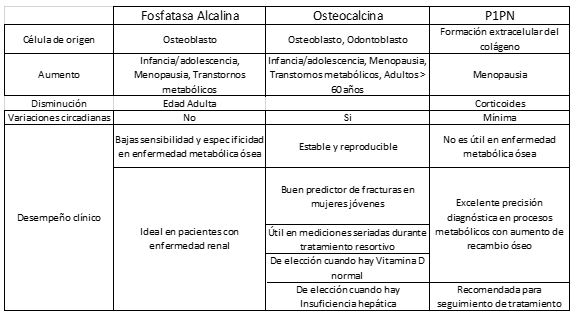
Así como cualquier biomarcador hay factores que deben tenerse en cuenta para asegurar resultados adecuados. En general, los marcadores de formación ósea son más estables que los de resorción, así como aquellos que son determinados en suero muestran menor variabilidad que los que se procesan en orina, estos últimos están afectados por el tiempo de recolección y variaciones circadianas en su excreción, a diferencia de las muestras en suero o plasma en donde factores interferentes comunes como la adecuada recolección de la muestra y separación del suero o plasma, hemólisis, bilirrubinemia o lipemia afectan las mediciones. Otros aspectos que generan variabilidad y que no son controlables deberán tenerse en cuenta durante el análisis de resultados como son etnia, frecuencia de fracturas, enfermedades, deficiencias de vitaminas, embarazo entre otras.
Por otro lado, la Fundación Internacional de Osteoporosis (IOF) y la Federación Internacional de Química Clínica y Medicina de Laboratorio (IFCC) crearon un grupo de trabajo conjunto para estandarizar y generar recomendaciones, consensos y aplicaciones de los marcadores de recambio óseo que definan la frecuencia de uso en la predicción del riesgo de fractura y el seguimiento del tratamiento con base en evidencias y publicaciones científicas disponibles.
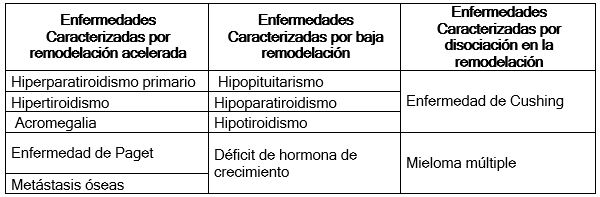
Utilidad clínica. La densidad mineral ósea es el examen diagnóstico de base para la valoración de la calidad ósea, sin embargo, ante su imposibilidad de evidenciar cambios a corto plazo, los marcadores de recambio óseo han sido de gran importancia para valorar la efectividad de la terapia antiresortiva mostrando resultados con buena precisión y confiabilidad que determinan la efectividad o necesidad de ajustes en los medicamentos. La evaluación del ritmo de recambio óseo en la menopausia es una información que los marcadores brindan para la predicción de pérdida de masa ósea y riesgo de desarrollar osteoporosis, también proporciona información importante para decidir si la paciente se va a beneficiar con el manejo preventivo de la osteoporosis. Otro beneficio de los biomarcadores es la Identificación de individuos con alto riesgo de fracturas. Cuando una paciente presenta remodelación ósea elevada, superior a dos desviaciones estándar sobre la media, tiene mayor riesgo de fractura. Remodelaciones muy altas superiores a tres desviaciones estándar, deberá evaluarse la presencia de otras patologías conjuntas tales como mieloma, tumor maligno o metástasis.
Velez Lab tiene disponible en su portafolio de productos biomarcadores bioquímicos de recambio óseo en los analizadores Maglumi para el seguimiento del paciente con enfermedades que afectan la calidad de los huesos y otros ensayos que son de gran ayuda en el estudio del metabolismo óseo como CTX, Osteocalcina, PTH intacta, Calcitonina, 25 OH Vitamina D, Calcitonina y próximamente P1PN
Bibliografía
- Alcoy.san.gva.es/laboratorio/web/BIOMARCADORES_REMODELADO_OSEO.pdf
- Hlaing T.y Compston.,J. E. Biochemical markers of bone turnover – uses and limitations. Annals of Clinical Biochemistry 2014, Vol. 51(2) 189–202
- Harjit P. Bhattoa a, Etienne Cavalier b , Richard Eastell c , Annemieke C. Heijboer d , Niklas R. Jørgensen e,f , Konstantinos Makris g,h , Candice Z. Ulmeri , John A. Kanisj , Cyrus Cooper k , Stuart L. Silverman l , Samuel D. Vasikaran m,. Analytical considerations and plans to standardize or harmonize assays for the reference bone turnover markers PINP and β-CTX in blood. Clinica Chimica Acta Volume 515, April 2021, Paginas 16-20.
- Kuo T.R. y Chen, H.C. Bone biomarker for the clinical assessment of osteoporosis: recent developments and future perspectives. Biomarker Research (2017) 5:18.
- Pozzo, M.J. Uso De Marcadores De Remodelación Ósea En La Práctica Clínica. Actual. Osteol 2014; 10(2): 177-185
Romero, C. Manrique,S. Marcadores bioquímicos en osteoporosis. Utilidad en la práctica clínica. Reumatología Clínica. Volume 8, Issue 3, May–June 2012, Pages 149-152