Interferencias en las Pruebas de Inmunoensayo

Utilidad de los Marcadores Bioquímicos de Recambio Óseo
octubre 25, 2022
Biomarcadores para el Diagnóstico Oportuno de Preeclampsia
diciembre 26, 2022Los inmunoensayos son actualmente los métodos de elección para la medición de un gran panel de moléculas complejas y heterogéneas debido a la automatización total, el tiempo de respuesta corto, la alta especificidad y la sensibilidad. A pesar de los desempeños notables, los inmunoensayos son propensos a varios tipos de interferencias que pueden tener consecuencias adversas para el paciente (p. ej., prescripción de un tratamiento inadecuado, diagnóstico tardío, investigaciones invasivas innecesarias).
A pesar de los múltiples y cuidadosos esfuerzos de los desarrolladores y grandes fabricantes de pruebas de laboratorio y la vigilancia del personal de laboratorio que realiza estas pruebas, no están exentos de presentarse interferencias que conducen a falsos positivos o falsos negativos.
Los diferentes procedimientos de medida inmunoensayos son susceptibles a interferencias tanto exógenas como endógenas en cualquiera de sus etapas: desde la reacción antígeno-anticuerpo hasta la fase de detección, esto es debido fundamentalmente a que las mediciones de las diferentes magnitudes biológicas se realizan en las matrices complejas que constituyen los especímenes y en ellos se encuentran muchas sustancias que pueden reaccionar o interactuar con los reactivos utilizados. En algunos Casos se conoce el mecanismo de la interferencia. pero a menudo este difiere de acuerdo con el tipo de procedimiento utilizado.
Las interferencias que pueden aparecer en los procedimientos inmunológicos son una fuente de errores esporádicos difíciles de delectar con los medios convencionales de control de la calidad. En ocasiones solo se pueden detectar ante la presencia de una discordancia entre los datos clínicos del paciente y el resultado de la medición.
Naturaleza de las interferencias:
Definiciones
Interferente: Componente de una muestra, distinta del componente que se desea determinar, que causa una interferencia.
Interferente Endógeno: Componente de una muestra. que está presente en ella en condiciones fisiológicas o patológicas, que causa una interferencia.
Interferencia Endógena: Error sistemático producido en el proceso analítico por un interferente endógeno.
Interferencia Exógena: Error sistemático producido en un proceso analítico por un interferente no endógeno o exógeno.
Propiedades de una sustancia interferente:
1. Única de un individuo.
2. Concentración variable en el tiempo.
3. Pueden producir resultados falsos positivos y falsos negativos.
4. Pueden interferir con uno o varios inmunoensayos, pero no necesariamente con todos.
5. Pueden interferir para diferentes analitos.
6. Anticuerpos interferentes de baja afinidad poli específicos, pueden estar presentes en altas concentraciones o bien anticuerpos interferentes de alta afinidad pueden estar presentes en bajas concentraciones.
7. La inclusión por los fabricantes de los inmunoensayos de uno o más agentes en el kit de reactivos con el fin de bloquear la interferencia puede ser suficiente o no para eliminar la interferencia.
Las interferencias en los inmunoensayos se dividen en 2 categorías amplias: independientes del analito y dependientes del analito.
Dentro de las interferencias independientes del analito podemos destacar aquellas que se derivan de la fase pre analítica, existen muchas posibles causas pre analíticas de resultados falsos en inmunoensayos, y estos deben ser excluidos metódicamente, como por ejemplo, la lipemia, la hemolisis y la ictericia, aunque hoy en día estos índices séricos se han logrado controlar en la mayoría de inmunoensayos, se debe considerar no emplear muestras que contengan estos índices en grandes cantidades visiblemente detectables.
Por lo tanto, definir el tipo de muestra a utilizar en los diferentes analitos es de vital importancia para evitar interferencias. Por ejemplo, suero o plasma, el tipo de anticoagulante empleado, plasma con EDTA para determinación de ACTH y no suero, heparina de litio. La heparina es un anticoagulante relativamente pobre y una centrifugación inicial inadecuada, o un tiempo prolongado antes de la toma de muestras, puede dar lugar a la formación de micro coágulos que son conocidos por generar resultados falsos en los inmunoensayos. En estos casos es necesario volver a centrifugar las muestras.
El arrastre o transferencia, si bien no debería ser un problema con los instrumentos modernos, se debe considerar el potencial de transferencia comúnmente conocido como arrastre entre muestra y muestra; por ejemplo; ocasionalmente habrá concentraciones extremadamente altas de marcadores tumorales o β-hCG y si las muestras no se lavan correctamente, la siguiente muestra puede estar contaminada y dar un resultado erróneamente alto, esto se podría corregir mediante la implementación de controles de calidad externos orientados a determinar y detectar este inconveniente.
La mayoría de los inmunoensayos ahora usan quimioluminiscencia como señal en inmunoensayos que utilizan ésteres de acridinio o derivados de luminol y partículas o micro partículas paramagnéticas como herramienta de separación. Algunos usan biotina y streptavidina como herramienta de separación y rutenio para una señal electroquimioluminiscente. Se han informado y detectado anticuerpos contra el rutenio y también biotina. Además, el uso indiscriminado y terapéutico de la biotina ha causado resultados falsos en el inmunoensayo lo que interviene en la medición durante el proceso.
Interferentes Dependientes
Sustancias de reacción cruzada: una de las ventajas del inmunoensayo es la especificidad única del anticuerpo por el analito y a la vez uno de los problemas del inmunoensayo es que cuando las diferencias estructurales son muy pequeñas, por ejemplo, cortisol y prednisolona, puede haber una reactividad cruzada sustancial, la reactividad cruzada entre antígenos se produce cuando un anticuerpo producido contra un antígeno específico tiene una alta afinidad competitiva hacia un antígeno diferente.
Anticuerpos Heterófilos: Los anticuerpos heterófilos son anticuerpos naturales, poli-específicos, generalmente de baja afinidad, que después de la exposición al antígeno, se reemplazan por anticuerpos de alta afinidad. Debido a su afinidad relativamente baja, por lo general, interfieren en los inmunoensayos.
Anticuerpos Humanos Anti ratones (HAMA): Estos son específicos e interactúan fuertemente con los anticuerpos del ensayo. Los pacientes los desarrollan debido al tratamiento con anticuerpos terapéuticos (animales) o a la estrecha asociación con esos animales. Los anticuerpos humanos anti-ratón son los más comunes y se utilizan con mayor frecuencia en reactivos de ensayo.
Autoanticuerpos. Estos se encuentran principalmente en personas con trastornos autoinmunes. Por ejemplo, los pacientes con enfermedad tiroidea tienen anticuerpos anti tiroideos; El factor reumatoide (RF) es un auto anticuerpo dirigido contra la porción Fc de la IgG de un individuo. Es común que hasta el 25% de las personas mayores tengan RF presente en la sangre. RF ha sido identificado como un interferente en varios ensayos incluyendo cTnI y hormonas tiroideas.
Efecto Prozona: el efecto prozone es un tipo específico de interferencia que se encuentra sólo en ensayos sándwich de un solo paso con concentraciones de analito muy altas. Las moléculas de analito, bajo esta condición, saturan todos los anticuerpos reactivos, produciendo así solo interferencia negativa. La mejor manera de resolver la interferencia de prozona es diluir las muestras y volver a ejecutar el ensayo.
Anticuerpos Terapéuticos: Estos son anticuerpos administrados terapéuticamente o sus fragmentos a través de medicamentos, estos anticuerpos terapéuticos interferirán en los inmunoensayos hasta que sean excretados por los riñones.
Componentes Endógenos: Componentes séricos endógenos elevados, como la bilirrubina (ictericia), la hemoglobina (hemólisis), los lípidos (turbidez) y proteínas interfieren más en ensayos homogéneos que heterogéneos, debido a que no hay procesos de lavado y separación de los complejos inmunes afectando directamente la medición. Algunos de los analizadores automatizados pueden marcar los resultados en los que dicha interferencia puede estar presente. Al igual que con la presencia de anticuerpos interferentes, la preparación de diluciones de la muestra es una forma común de resolver estas interferencias.
Efecto de Matriz. Esta situación es consecuencia de la interacción inespecífica entre la muestra y los reactivos del ensayo y es otro tipo de interferencia del inmunoensayo. Los fabricantes y laboratorios usan varias proteínas o surfactantes y optimizan sus tampones de ensayo y fuerza iónica para minimizar el efecto de la matriz.
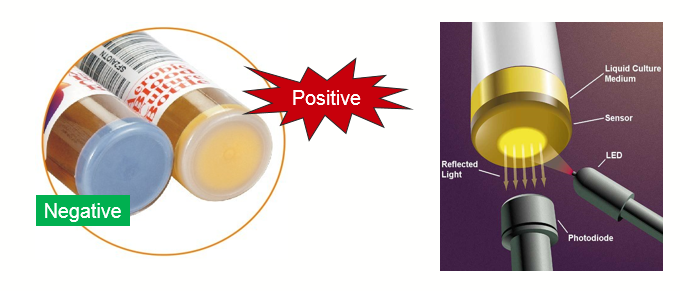
Otros Interferentes. Las muestras que contienen enzimas o sustratos similares a los utilizados en los inmunoensayos pueden generar resultados incorrectos. Ejemplo de esto es el caso de muestras con fosfatasa alcalina elevada que pueden dar resultados incorrectos en ensayos que emplean la enzima en los conjugados. Situación semejante ocurre con la presencia de biotina en las muestras cuando se utilizan reactivos que la contienen.
Las muestras también pueden contener moléculas que inhiben o modulan las enzimas de ensayo, causando así interferencia.
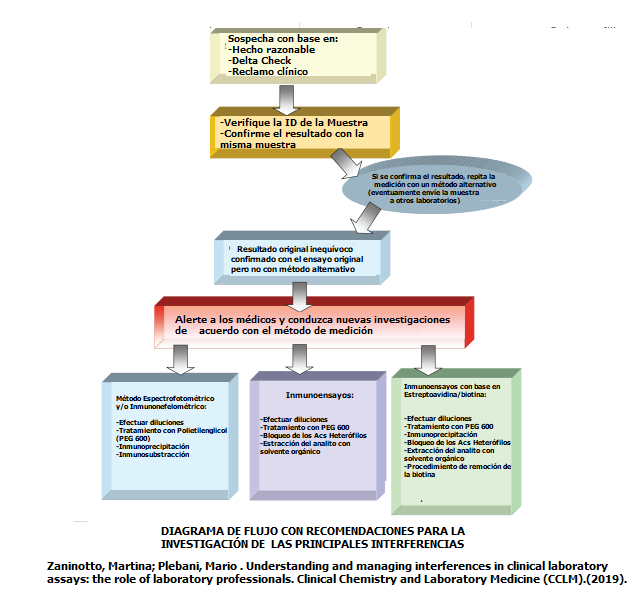
Se puede concluir que las interferencias siempre van a estar presentes y no se identificarán a menos que los analistas estén alertas y sospechen de los resultados que arrojan los analizadores.
Se debe tener mucho cuidado en el manejo de la muestra y tener controladas todas las variables pre analíticas para obtener resultados de buena calidad.
Adicionalmente, los bacteriólogos deben trabajar en equipo, conocer muy bien sus analizadores, su control de calidad y los posibles interferentes que se presenten y a la vez trabajar en estrecha colaboración con los médicos para identificar los resultados incorrectos de los inmunoensayos, identificar las causas fundamentales, resolver las interferencias e informar los resultados correctos. Estos esfuerzos valdrán la pena para ayudar con un diagnóstico más rápido, eficaz y correcto con el fin de evitar costos innecesarios
BIBLIOGRAFIA
- Barceló Martín, B. Interferencias analíticas en Inmunoensayos. An Clin; 2007. 32(2):47-52
- Domenech M, Clar y Gascon N, Roche. Interferencias en los procedimientos de medida inmunoquimicos. 1997 16 (4) 214-217
- Katzman, B y Baumann N. Investigating Immunoassay Interferences. Abril 1,2022. AACC.org
- Pradip Datt. How to Detect and Solve Immunoassay Interference. Oct.1, 2015. AACC.org
- Tate, J., & Ward, G. (2004). Interferences in immunoassay. The Clinical Biohemist. Reviews, 25(2), 105–120.
- Ward, G. Simpson A. b, d, Lyn Boscato c, Peter E. Hickman. The investigation of interferences in immunoassay. Clinical Biochemistry 50(2017) 1306 – 1311
- Zaninotto, Martina; Plebani, Mario. Understanding and managing interferences in clinical laboratory assays: the role of laboratory professionals. Clinical Chemistry and Laboratory Medicine (CCLM). (2019).