Aplicación de Pruebas Rápidas en el Diagnóstico por COVID-19

Calprotectina Fecal:
febrero 16, 2021
Lo que debes saber sobre la metodología por Quimioluminiscencia
febrero 16, 2021Introducción
El SARS-CoV-2 es una nueva cepa que no se ha identificado previamente en humanos. El nuevo coronavirus 2019 (SARS-CoV-2) es un virus que fue identificado por primera vez en Wuhan, China como la causa de un brote de enfermedad respiratoria. Según los informes, los pacientes con SARS-CoV-2 cursan con un cuadro clínico que va de leve a grave con síntomas como fiebre, tos, falta de aliento y que pueden llegar hasta la presencia de neumonía, síndrome respiratorio agudo severo, insuficiencia renal e, incluso, la muerte. Por lo tanto, las pruebas rápidas se han convertido en una necesidad urgente para la detección de presencia de enfermedad por Covid 19 en los pacientes.

Actualmente numerosos Test rápidos basados en la reacción antígeno-anticuerpo están en desarrollo y dentro de estas pruebas se diferencian aquellas que detectan antígeno y las que detectan anticuerpos (IgM, IgG). De forma general, son pruebas cualitativas, solo ofrecen un resultado positivo o negativo. Las principales técnicas de detección de antígeno y anticuerpos son:
● Técnicas de aglutinación indirecta o pasiva.
● Inmunofluorescencia.
● Enzimoinmunoanálisis.
● Contrainmunoelectroforesis.
● Métodos luminométricos.
● Inmunocromatografía.
De éstas las más comúnmente usadas para el diagnóstico rápido de SARS-CoV-2 son los enzimoinmunoanálisis (ELISA) y sobre todo la inmunocromatografía (flujo lateral).
Técnicas de Detención de Anticuerpos (IgM/IgG):
¿Qué detectan? Detectan la presencia de anticuerpos IgM e IgG frente SARS-CoV-2 en una muestra de sangre, suero o plasma. Hay test rápidos que detectan los anticuerpos totales y otros que diferencian entre las IgM e IgG, y pueden detectarlas individualmente o ambas en el mismo kit.
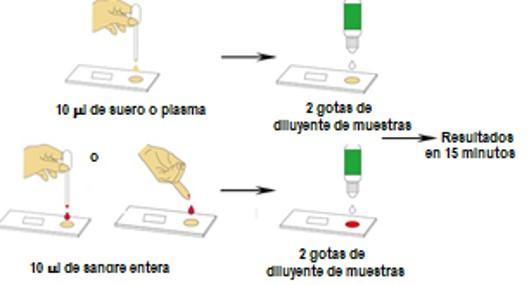
¿Cómo debe realizarse la prueba? Los Test rápidos se realizan en una muestra de sangre capilar obtenida del dedo del paciente, o a partir de plasma o suero. Los kits por inmunocromatografía de flujo lateral incluyen casetes, una solución tampón o diluyente, un tubo capilar o pipetas en algunos casos para dispensar la muestra, adicionalmente se requiere de guantes, una lanceta (para punción capilar) o tubo de recolección de sangre al vacío, alcohol y gasas.
Cómo es su procedimiento y lectura? Se toma una muestra de sangre capilar del dedo del paciente. Se recoge la muestra con el tubo capilar (o pipeta), se coloca la muestra de sangre en el casete, se añade el tampón o diluyente y se obtiene los resultados en unos 15 minutos. El procedimiento es similar si se utiliza suero o plasma. Para determinar como válida la corrida, el casete cuenta con una banda de control que debe aparecer marcada al final del período de incubación. Si además aparece coloreada la línea M indica positividad del anticuerpo IgM, si aparece la línea G, indicará positividad para IgG y si se marcan ambas líneas, hay positividad de IgG e IgM.
Procedimiento
Lectura
Resultado Negativo

Resultados PositivosAnticuerpos Ig G positivos

Anticuerpos IgM Positivos

Anticuerpos IgG e IgM Positivos

Resultado Inválidos

Qué características de rendimiento clínico deben tener las pruebas rápidas para anticuerpos?
Según los lineamientos para el uso de pruebas diagnósticas de SARS-COV-2 (COVID- 19) en Colombia, los test rápidos deben tener:
- Sensibilidad por encima del 85% y especificidad por encima del 90%
- Reporte sobre el porcentaje de correlación (tasa de coincidencia) con la PCR que es la prueba confirmatoria, debe ser mayor del 80%.
- Que el número de muestras con el cual la casa comercial hizo la validación sea como mínimo de 100.
¿Cuándo debe realizarse la prueba?
Las pruebas rápidas serológicas de anticuerpos IgM/IgG se indican para identificar el contacto previo de una persona con el virus SARS-CoV2. No se consideran pruebas diagnósticas y no se recomienda su uso para descartar un caso de infección aguda.
Según el Ministerio de salud se podrán realizar pruebas rápidas de anticuerpos IgM/IgG a las siguientes personas:
- Persona con síntomas leves sin factores de riesgo, se debe tomar la prueba nunca antes de 10 días de inicio de los síntomas.
- Contacto estrecho con síntomas leves y sin factores de riesgo, se debe tomar la prueba nunca antes de 10 días de inicio de los síntomas.
- Persona asintomática con o sin factores de riesgo que haya sido contacto estrecho de un caso confirmado
Sin embargo, su uso puede extenderse y aplicarse para tamizaje de población que potencialmente haya estado expuesta al virus en especial personal médico o paramédico para tomar medidas de aislamiento apropiadas.
Según los estudios recientes se ha observado que tras la infección se generan anticuerpos de tipo IgM y aunque parece que empiezan a elevarse aproximadamente 5-7 días tras la infección, los test los detectan mejor a los 8-14 días. Pasados 15-21 días aparecen los anticuerpos de tipo IgG.

¿Cómo se interpretan las pruebas rápidas?
Un resultado positivo indicaría infección por SARS-CoV-2 ya que implica la formación de inmunidad contra el virus
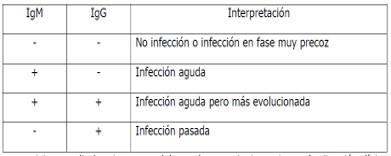
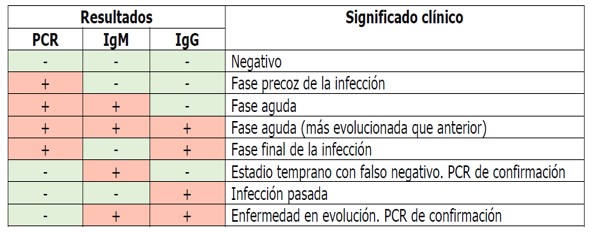
Tenga en cuenta que las pruebas rápidas de Anticuerpos IgG/igM por si solas no son pruebas diagnósticas, son complementarias con la prueba de PCR para llegar al diagnóstico confirmatorio de la infección por Covid 19.
Bibliografía
1. Lineamientos para el uso de pruebas diagnósticas de SARS-COV-2 (COVID- 19) en Colombia. https://www.minsalud.gov.co/RID/lineamientos-pruebas-lsp-covid-19.pdf
2. Laboratory testing for 2019 novel coronavirus (2019-nCoV) in suspected human cases. Interim guidance. 19 March 2020. https://www.who.int/publications-detail/laboratory-testing-for-2019-novel-coronavirus-in-suspected-human-cases-20200117. Consultado 31 marzo 2020.
3. Wang W, Xu Y, Gao R, et al. Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA. Published online March 11, 2020. doi:10.1001/jama.2020.3786.
4. Interim Guidelines for Collecting, Handling, and Testing Clinical Specimens from Persons for Coronavirus Disease 2019 (COVID-19) https://www.cdc.gov/coronavirus/2019-nCoV/lab/guidelines-clinical-specimens.html. Consultado 28 Marzo 2020.
5. World Health Organization (2020) Novel Coronavirus (2019-nCoV) technical guidance: Laboratory testing for 2019-nCoV in humans. 31 Jan 2020. Available at: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/technicalguidance/laboratory-guidance. Consultado 26 Marzo 2020.
6. Guidance on regulations for the transport of infectious substances 2019–2020. Ginebra, Organización Mundial de la Salud, 2019. (https://www.who.int/ihr/publications/WHOWHE-CPI-2019.20/en/). Consultado 28 Marzo 2020.
7. Corman VM, Landt O, Kaiser M, Molenkamp R, Meijer A, Chu DKW, et al. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Euro Surveill. 2020;25(3):2000045. https://doi.org/10.2807/1560-7917.ES.2020.25.3.2000045 PMID: 31992387.
8. Chu, D. K. W., Pan, Y., Cheng, S. M. S., Hui, K. P. Y., Krishnan, P., Liu, Y., Ng, D. Y. M., Wan, C. K. C., Yang, P., Wang, Q., Peiris, M., & Poon, L. L. M. (2020). Molecular Diagnosis of a Novel Coronavirus (2019-nCoV) Causing an Outbreak of Pneumonia. Clinical Chemistry, 555, 549–555. https://doi.org/10.1093/clinchem/hvaa029
9. Lippi, G., Simundic, A.-M., & Plebani, M. (2020). Potential preanalytical and analytical vulnerabilities in the laboratory diagnosis of coronavirus disease 2019 (COVID-19). Clinical Chemistry and Laboratory Medicine (CCLM), 0(0). https://doi.org/10.1515/cclm-2020-0285
10. Zou L et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. N Engl J Med. 2020;382(12):1177–9.
11. Jason Chin-Huat YAP, Ian Yi Han ANG, Sharon Hui Xuan TAN, Jacinta I-Pei CHEN, Ruth Frances LEWIS, Qian YANG, Rowena Kah Sin YAP, Bob Xian Yi NG, Hao Yi TAN (2020-02-27). COVID-19 Science Report: Diagnostics. ScholarBank@NUS Repository. https://doi.org/10.25540/e3y2-aqye
12. Corman, V. M., Landt, O., Kaiser, M., et al. (2020). Detection of 2019 novel coronav